一般的名称
デソゲストレル
エチニルエストラジオール経口避妊剤は、HIV感染(エイズ)及び他の性感染症(例えば梅毒、性器ヘルペス、淋病、クラミジア感染症、尖圭コンジローマ、腟トリコモナス症、B型肝炎等)を防止するものではないこと、これらの感染防止にはコンドームの使用が有効であることを服用者に十分に説明すること。
なお、必要に応じ、性感染症検査の実施を考慮すること。
禁忌(次の患者には投与しないこと)
1. 本剤の成分に対し過敏性素因のある女性
2. エストロゲン依存性悪性腫瘍(例えば乳癌、子宮内膜癌)、子宮頸癌及びその疑いのある患者[腫瘍の悪化あるいは顕性化を促すことがある。]
3. 診断の確定していない異常性器出血のある患者[性器癌の疑いがある。出血が性器癌による場合は、癌の悪化あるいは顕性化を促すことがある。]
4. 血栓性静脈炎、肺塞栓症、脳血管障害、冠動脈疾患又はその既往歴のある患者[血液凝固能が亢進され、これらの症状が増悪することがある。]
5. 35歳以上で1日15本以上の喫煙者[心筋梗塞等の心血管系の障害が発生しやすくなるとの報告がある。]
6. 前兆(閃輝暗点、星型閃光等)を伴う片頭痛の患者[前兆を伴う片頭痛の患者は前兆を伴わない患者に比べ脳血管障害(脳卒中等)が発生しやすくなるとの報告がある。]
7. 肺高血圧症又は心房細動を合併する心臓弁膜症の患者、亜急性細菌性心内膜炎の既往歴のある心臓弁膜症の患者[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。]
8. 血管病変を伴う糖尿病患者(糖尿病性腎症、糖尿病網膜症等)[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。]
9. 血栓性素因のある女性[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。]
10. 抗リン脂質抗体症候群の患者[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。]
11. 手術前4週以内、術後2週以内、産後4週以内及び長期間安静状態の患者[血液凝固能が亢進され、心血管系の副作用の危険性が高くなることがある。]
12. 重篤な肝障害のある患者
13. 肝腫瘍のある患者[症状が増悪することがある。]
14. 脂質代謝異常のある患者[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。また、脂質代謝に影響を及ぼす可能性があるため、症状が増悪することがある。]
15. 高血圧のある患者(軽度の高血圧の患者を除く)[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。また、症状が増悪することがある。]
16. 耳硬化症の患者[症状が増悪することがある。]
17. 妊娠中に黄疸、持続性そう痒症又は妊娠ヘルペスの既往歴のある患者[症状が再発するおそれがある。]
18. 妊婦又は妊娠している可能性のある女性
19. 授乳婦
20. 骨成長が終了していない可能性がある女性[骨端の早期閉鎖を来すおそれがある。]
21. オムビタスビル水和物・パリタプレビル水和物・リトナビル配合剤を投与中の患者
効能又は効果
避妊
効能又は効果に関連する注意
- 本剤は、他の経口避妊剤の投与が適当でないと考えられる場合に投与を考慮すること。レボノルゲストレル等の経口避妊剤と比較して、静脈血栓症の相対危険率を増加させることを示唆する報告がある。
- 経口避妊剤使用開始1年間の飲み忘れを含めた一般的使用における失敗率は9%との報告がある。
用法及び用量
- 〈21錠製剤〉
1日1錠を毎日一定の時刻に計21日間連続経口投与し、その後7日間休薬する。同様の方法で、避妊する期間繰り返し投与する。
- 〈28錠製剤〉
1日1錠を毎日一定の時刻に白色錠を21日間連続経口投与し、続けて緑色錠を7日間、合計28日間連続投与する。次周期以降は、消退出血の有無にかかわらず、引き続き白色錠より投与を開始し、28日間連続投与する。したがって、1周期目の投与開始より休薬期間は一切とらない。通常、緑色錠服用中に月経(消退出血)が発来する。
用法及び用量に関連する注意
- 毎日一定の時刻に服用させること。
- 服用開始日
経口避妊剤を初めて服用する場合、月経第1日目から服用を開始すること。服用開始日が月経第1日目から遅れた場合、妊娠する可能性があるため、飲みはじめの最初の1週間は他の避妊法を併用すること。 - 本剤の投与にあたっては、飲み忘れ等がないよう服用方法等を十分指導すること。万一飲み忘れがあった場合(28錠製剤の緑色錠を除く)、翌日までに気付いたならば直ちに飲み忘れた錠剤を服用し、その日の錠剤も通常どおりに服用させる。2日以上連続して飲み忘れがあった場合は服用を中止させ、次の月経を待ち投与を再開させること。
なお、飲み忘れにより妊娠する可能性が高くなるので、その周期は他の避妊法を使用させること。 - 他の経口避妊剤から本剤に切り替える場合
- 21錠タイプの経口避妊剤から切り替える場合
前に服用していた薬剤をすべて服用し7日間の休薬の後、続けて本剤の服用を開始させる。服用開始が遅れた場合、妊娠の可能性がある。 - 28錠タイプの経口避妊剤から切り替える場合
前に服用していた薬剤をすべて服用後、続けて本剤の服用を開始させる。服用開始が遅れた場合、妊娠の可能性がある。
- 21錠タイプの経口避妊剤から切り替える場合
重要な基本的注意
- 本剤の服用により、年齢、喫煙、肥満、家族歴等のリスク因子の有無にかかわらず血栓症があらわれることがあるので、次のような症状があらわれた場合は直ちに投与を中止し、適切な処置を行うこと。
- 緊急対応を要する血栓症の主な症状
- 下肢の急激な疼痛・腫脹、突然の息切れ、胸痛、激しい頭痛、四肢の脱力・麻痺、構語障害、急性視力障害等
- 緊急対応を要する血栓症の主な症状
- 本剤服用者に対しても、このような症状があらわれた場合は、直ちに服用を中止し、救急医療機関を受診するよう説明すること。
- 本剤の服用中に、血栓症が疑われる症状があらわれた場合は、投与を中止するなど適切な処置を行うこと。
- 血栓症が疑われる症状
- 下肢の疼痛・腫脹・しびれ・発赤・熱感、頭痛、嘔気・嘔吐等
- 血栓症が疑われる症状
- 血栓症のリスクが高まる状態(体を動かせない状態、顕著な血圧上昇、脱水等)が認められる場合は、投与を中止するなど適切な処置を行うこと。
- 本剤服用者には、投与開始時及び継続時に以下について説明すること。
- 血栓症は生命に関わる経過をたどることがあること。
- 血栓症が疑われる症状があらわれた場合や、血栓症のリスクが高まる状態になった場合は、症状・状態が軽度であっても直ちに服用を中止し医師等に相談すること。
- 血栓症を疑って他の医療機関を受診する際は、本剤の使用を医師に告知し、本剤による血栓症を念頭においた診察を受けられるようにすること。
- 本剤服用中にやむを得ず手術が必要と判断される場合には、血栓症の予防に十分配慮すること。
- 年齢及び喫煙量により心血管系の重篤な副作用の危険性が増大するとの報告がある。従って、本剤服用者には禁煙するよう指導すること。
- 本剤の投与にあたっては、服用者の病歴調査及び検診が必要である。この検診には、血圧測定、乳房・腹部の検査及び臨床検査が含まれる。また、投与中は6ヵ月毎の検診を行うこと。
- 本剤投与開始前及び投与中は、1年に1回以上、子宮・卵巣を中心とした骨盤内臓器の検査を行うこと。1年に1回、子宮頸部の細胞診の実施を考慮すること。
- 乳癌の検査は、服用者に自己検診を行うよう指導すること。
- 服用中に不正性器出血が発現した場合、通常は投与継続中に消失するが、長期間持続する場合は、腟細胞診等の検査で悪性疾患によるものではないことを確認の上、投与すること。
組成・性状
組成
マーベロン21
| マーベロン21/28共通 | ||
| 有効成分 | 1錠中 デソゲストレル 0.15 mg |
|
| 1錠中 日局 エチニルエストラジオール 0.03 mg |
||
| 添加剤 | バレイショデンプン、ポビドン、ステアリン酸、軽質無水ケイ酸、トコフェロール、乳糖水和物、ヒプロメロース、マクロゴール400、酸化チタン、タルク | |
マーベロン28
| マーベロン21/28共通 | ||
| 有効成分 | 1錠中 デソゲストレル 0.15 mg |
|
| 1錠中 日局 エチニルエストラジオール 0.03 mg |
||
| 添加剤 | バレイショデンプン、ポビドン、ステアリン酸、軽質無水ケイ酸、トコフェロール、乳糖水和物、ヒプロメロース、マクロゴール400、酸化チタン、タルク | |
| マーベロン28のみ | ||
| 有効成分 | 1錠中 デソゲストレル 含有せず |
|
| 1錠中 日局 エチニルエストラジオール 含有せず |
||
| 添加剤 | トウモロコシデンプン、ステアリン酸マグネシウム、乳糖水和物、ヒプロメロース、マクロゴール400、酸化チタン、タルク、黄色三二酸化鉄、食用青色2号アルミニウムレーキ | |
製剤の性状
マーベロン21
| マーベロン21/28共通 | ||
| 剤形 | フィルムコーティング錠 | |
| 色調 | 白色 | |
| 外形 | 表面 |  |
| 裏面 |  |
|
| 側面 | ||
| 大きさ | 直径 | 5.0mm |
| 厚さ | 2.9mm | |
| 質量 | 66mg | |
| 識別コード | TR5 ☆ORGANON |
|
| 錠数 | 21錠 | |
マーベロン28
| マーベロン21/28共通 | ||
| 剤形 | フィルムコーティング錠 | |
| 色調 | 白色 | |
| 外形 | 表面 |  |
| 裏面 |  |
|
| 側面 | ||
| 大きさ | 直径 | 5.0mm |
| 厚さ | 2.9mm | |
| 質量 | 66mg | |
| 識別コード | TR5 ☆ORGANON |
|
| 錠数 | 21錠 | |
| マーベロン28のみ | ||
| 剤形 | フィルムコーティング錠[プラセボ錠] | |
| 色調 | 緑色 | |
| 外形 | 表面 | 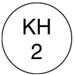 |
| 裏面 |  |
|
| 側面 | ||
| 大きさ | 直径 | 5.0mm |
| 厚さ | 2.8mm | |
| 質量 | 65mg | |
| 識別コード | KH2 ☆ORGANON |
|
| 錠数 | 7錠 | |
併用禁忌(併用しないこと)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
オムビタスビル水和物・パリタプレビル水和物・リトナビル配合剤
|
エチニルエストラジオール含有経口避妊剤を併用した患者においてALT上昇が高頻度に認められている。 なお、オムビタスビル水和物・パリタプレビル水和物・リトナビル配合剤治療終了の約2週間後から本剤の投与を再開できる。 |
機序不明 |
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
副腎皮質ホルモン
三環系抗うつ剤
セレギリン塩酸塩 |
これらの薬剤の作用が増強するおそれがある。 | 本剤はこれらの薬剤の代謝を抑制すると考えられる。 |
| リファンピシン バルビツール酸系製剤
ヒダントイン系製剤
カルバマゼピン |
本剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがある。 | これらの薬剤は薬物代謝酵素を誘導し、本剤の代謝を促進すると考えられる。 |
テトラサイクリン系抗生物質
ペニシリン系抗生物質
|
本剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがある。 | これらの薬剤は腸内細菌叢を変化させ、本剤の腸肝循環による再吸収を抑制すると考えられる。 |
| テルビナフィン塩酸塩 | 黄体ホルモン・卵胞ホルモン配合剤との併用で、月経異常があらわれたとの報告がある。 | 機序不明 |
Gn-RH誘導体
|
これらの薬剤の作用を減弱するおそれがある。 | これらの薬剤は性ホルモンの分泌を低下することにより薬効を示すため、性ホルモンである本剤の投与によってこれらの薬剤の効果を減弱する可能性が考えられる。 |
血糖降下剤
|
血糖降下剤の作用が減弱することがある。血糖値その他患者の状態を十分観察し、血糖降下剤の用量を調節するなど注意する。 | 本剤は耐糖能を低下させ、血糖降下剤の作用を減弱させると考えられる。 |
| ラモトリギン | 経口避妊剤との併用でラモトリギンの血中濃度が減少したとの報告があるので、ラモトリギン維持用量投与中に本剤を投与開始又は中止する場合は、ラモトリギンの用量調節を考慮すること。 | 肝におけるラモトリギンのグルクロン酸抱合が促進される。 |
| モルヒネ サリチル酸 |
これらの薬剤の血中濃度が低下するおそれがある。 | 本剤はこれらの薬剤のグルクロン酸抱合を促進すると考えられる。 |
| HIV感染症治療薬 HIVプロテアーゼ阻害剤
非ヌクレオシド系逆転写酵素阻害剤
|
本剤の作用が減弱するおそれがある。 | エチニルエストラジオールのAUCが減少する。 |
|
本剤の作用が減弱するおそれがある。 | デソゲストレルの活性代謝物であるエトノゲストレルの血中濃度が低下する。 |
|
本剤の血中濃度が上昇するおそれがある。 | エトラビリンは本剤の代謝酵素(CYP2C9)を阻害すると考えられる。 |
HCV感染症治療薬
|
本剤の作用が減弱するおそれがある。 | エチニルエストラジオールのAUCが減少する。 |
| フルコナゾール イトラコナゾール |
本剤の血中濃度が上昇するおそれがある。 | 本剤の代謝酵素(CYP3A4)を阻害すると考えられる。 |
| ボリコナゾール | 本剤の血中濃度が上昇するおそれがある。ボリコナゾールの血中濃度が上昇するおそれがある。 | ボリコナゾールは本剤の代謝酵素(CYP3A4)を阻害すると考えられる。 本剤がボリコナゾールの代謝酵素(CYP2C19)を阻害すると考えられる。 |
| アセトアミノフェン | 本剤の血中濃度が上昇するおそれがある。アセトアミノフェンの血中濃度が低下するおそれがある。 | アセトアミノフェンはエチニルエストラジオールの硫酸抱合を阻害すると考えられる。本剤が肝におけるアセトアミノフェンのグルクロン酸抱合を促進すると考えられる。 |
| セイヨウオトギリソウ (St. John’s Wort, セント・ジョーンズ・ワート)含有食品 |
本剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | この食品は薬物代謝酵素を誘導し、本剤の代謝を促進すると考えられる。 |
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
血栓症(四肢、肺、心、脳、網膜等)(頻度不明)
下肢の急激な疼痛・腫脹、突然の息切れ、胸痛、激しい頭痛、四肢の脱力・麻痺、構語障害、急性視力障害等の症状があらわれた場合には直ちに投与を中止し、適切な処置を行うこと。
その他の副作用
| 5%以上 | 0.1~5%未満 | 頻度不明 | |
| 過敏症 | 発疹 | ||
| 眼 | 視力障害 | 網膜血流障害による視力障害 | |
| 肝臓 | 肝機能異常、AST上昇、ALT上昇 | 黄疸 | |
| 代謝 | ナトリウムや体液の貯留による浮腫、体重増加 | ||
| 生殖系 | 不正性器出血(破綻出血、点状出血)、帯下、月経過多、月経痛、性交痛、リビドー減退 | ||
| 乳房 | 乳房痛 | 乳房緊満(感) | 乳汁漏出 |
| 循環器 | 期外収縮、血圧上昇、動悸 | ||
| 消化器 | 悪心 | 嘔吐、下痢、腹痛、便秘、食欲減退、胸やけ、腹部膨満感 | |
| 呼吸器 | 咽頭痛、咳嗽 | ||
| 精神神経系 | 頭痛 | めまい、眠気 | 抑うつ、いらいら感、片頭痛 |
| 皮膚 | ざ瘡、湿疹、そう痒感、色素沈着 、紅斑 | 脱毛 | |
| 筋骨格 | 腰痛、下肢痛、肩こり、手指のこわばり | ||
| その他 | 倦怠感、口渇、顔面浮腫、胸痛、白血球減少、アルドステロン上昇 |
注) 長時間太陽光を浴びないよう注意すること。
臨床検査結果に及ぼす影響
含有するエチニルエストラジオールの作用による血清蛋白(コルチコイド結合性グロブリン、サイロキシン結合性グロブリン等)の増加により、総コルチゾール、総T3、総T4の上昇がみられることがある。また、これらの遊離型は変化しないとされている。これら検査値の判定に際しては注意すること。
適用上の注意
薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症が併発することがある。
その他の注意
臨床使用に基づく情報
- 外国での疫学調査の結果、静脈血栓症のリスクは、経口避妊剤を服用している女性は服用していない女性に比し、3.25~4.0倍高くなるとの報告がある。また、静脈血栓症のリスクは経口避妊剤服用開始の最初の1年間において最も高くなるとの報告がある。さらに、外国での大規模市販後調査の結果、初めて経口避妊剤の服用を開始した時だけでなく、4週間以上の中断後に服用を再開した時又は4週間以上の中断後に別の経口避妊剤へ切り替えた時にも静脈血栓症のリスクが上昇し、そのリスクは服用開始後3ヵ月間が特に高いとの報告がある。
また、1995年~1996年にデソゲストレルを含む経口避妊剤はレボノルゲストレル等の経口避妊剤に比較して、静脈血栓症の相対危険率を増加させることを示唆する報告(レボノルゲストレル等の経口避妊剤による静脈血栓症の患者が1年間で1万人当たり1人であるのに対してデソゲストレルを含む経口避妊剤では2人になる)がある。ちなみに、妊娠による静脈血栓の発症は1年間で1万人当たり6人といわれている。 - 外国での疫学調査の結果、経口避妊剤の服用により乳癌及び子宮頸癌になる可能性が高くなるとの報告がある。
- 外国で、経口避妊剤を2年以上服用した場合、良性肝腫瘍が10万人当たり3.4人発生するとの報告がある。また、腫瘍の破裂により腹腔内出血を起こす可能性がある。一方、悪性肝腫瘍(肝癌)の発生率は極めて低く、100万人当たり1人に満たない。
- 外国で、経口避妊剤の服用により全身性エリテマトーデス(SLE)の悪化、アナフィラキシー様症状、溶血性尿毒症症候群(HUS)、血管浮腫があらわれたとの報告がある。
- 外国で、経口避妊剤の服用による角膜厚の変化等によりコンタクトレンズがうまく調整されないため、視力・視野の変化、装用時の不快感等がみられたとの報告がある。
薬物動態
血中濃度
健康成人女性に経口投与した場合、消化管からの吸収は速やかで、活性代謝物である3-ケト-デソゲストレル及びエチニルエストラジオールの血清中濃度は投与後約2時間で最高値に達する。また、反復投与した場合、3-ケト-デソゲストレル及びエチニルエストラジオールの血清中濃度はほぼ15日目に定常状態に達し、21日投与後の消失相半減期はそれぞれ22.0、23.7時間であった 。
| 表 21日間連続経口投与後の薬物動態パラメータ | ||||
| AUC (pmol・hr/mL) |
t1/2 (hr) |
Cmax (pmol/mL) |
Tmax (hr) |
|
| 3-ケト-デソゲストレル | 97.2 ± 36.8 | 22.0 ± 9.6 | 12.12 ± 5.49 | 1.2 ± 0.6 |
| エチニルエストラジオール | 11.7 ± 3.3 | 23.7 ± 8.8 | 1.18 ± 0.32 | 1.1 ± 0.6 |
排泄
健康成人女性に3H-標識デソゲストレルとエチニルエストラジオールを経口投与した場合、投与後8日目までに尿中には約48%、糞中には約35%が排泄された (外国人データ)。
臨床成績
有効性及び安全性に関する試験
国内臨床試験
避妊を希望する女性992例について実施された臨床試験において、薬剤に起因すると判定された妊娠が1例みられ、避妊効果は99.9%、延べ服用周期(14,088周期)におけるPearl indexは0.085であった 。
避妊を希望する女性1,011例(14,378周期)中、副作用が報告されたのは、258例(25.5%)で、主なものは、悪心119例(11.8%)、乳房痛85例(8.4%)、頭痛59例(5.8%)、不正性器出血24例(2.4%)、嘔吐23例(2.3%)、倦怠感12例(1.2%)、下痢11例(1.1%)、腹痛10例(1.0%)であった。また、臨床検査値の異常が報告されたものは、AST上昇及びALT上昇2例、白血球数減少1例、アルドステロン上昇1例の計4例であった。
その他
各種避妊法使用開始1年間の失敗率(妊娠率)は以下のとおりである。
| 方法 | 理想的な使用 (%) |
一般的な使用) (%) |
| 経口避妊剤 | 0.3 | 9 |
| レボノルゲストレル放出IUS | 0.2 | 0.2 |
| 銅付加IUD | 0.6 | 0.8 |
| コンドーム | 2 | 18 |
| リズム法 | 0.4~5 | 24 |
| 女性避妊手術 | 0.5 | 0.5 |
| 男性避妊手術 | 0.10 | 0.15 |
| 避妊せず | 85 | 85 |
| IUS:子宮内システム IUD:子宮内避妊用具
注1) 選んだ避妊法を正しく続けて使用しているにもかかわらず妊娠してしまった場合 注2) 選んだ避妊法を使用しているにもかかわらず妊娠してしまった場合(経口避妊剤については、飲み忘れを含めた場合の失敗率) |
||
薬効薬理
作用機序
本剤は排卵抑制作用を主作用とし、子宮内膜変化による着床阻害作用及び頸管粘液変化による精子通過性阻害等により避妊効果を発揮する。
排卵抑制作用
本剤の連続服用により、血中の黄体・卵胞ホルモン値は一定に保持される。その結果、脳下垂体前葉ゴナドトロピン分泌の生理的パターンが阻害され、ゴナドトロピン分泌の減少により、排卵が抑制される。
子宮内膜の性状変化による着床阻害作用
本剤の連続服用により、子宮内膜の性状が変化し、その結果、受精卵の着床が阻害される 。
子宮頸管粘液の変化による精子通過性阻害作用
本剤の連続服用により、子宮頸管粘液の性状や組成の変化が起こり、子宮腔内への精子の通過性が阻害される。
有効成分に関する理化学的知見
デソゲストレル
一般的名称
デソゲストレル(Desogestrel)
化学名
(+)-17α-Ethynyl-18-methyl-11-methylene-4-estren-17-ol
分子式
C22H30O
分子量
310.47
性状
白色の結晶性の粉末で、においはない。
アセトン、ジクロロメタン又はテトラヒドロフランに極めて溶けやすく、エタノール(99.5)又はジエチルエーテルに溶けやすく、ヘキサンにやや溶けやすく、水にほとんど溶けない。
化学構造式
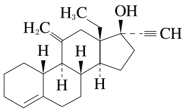
融点
110~112℃
エチニルエストラジオール
一般的名称
エチニルエストラジオール(Ethinylestradiol)
化学名
19-Nor-17α-pregna-1,3,5(10)-triene-20-yne-3,17-diol
分子式
C20H24O2
分子量
296.40
性状
白色~微黄色の結晶又は結晶性の粉末で、においはない。
ピリジン又はテトラヒドロフランに溶けやすく、エタノール(95)又はジエチルエーテルにやや溶けやすく、水にほとんど溶けない。水酸化ナトリウム試液に溶ける。
化学構造式
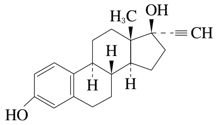
融点
180~186℃又は142~146℃
取扱い上の注意
本剤は小児の手の届かない場所に保管すること。
包装
- 〈マーベロン21〉
210錠[21錠(PTP) × 10]
1,050錠[21錠(PTP) × 50]
- 〈マーベロン28〉
280錠[28錠(PTP) × 10]
1,400錠[28錠(PTP) × 50]
マーベロン21/マーベロン28
作成又は改訂年月
| * | 2021年 9月改訂 ( 第2版 ) |
| 2019年 10月改訂 ( 第1版 ) |
日本標準商品分類番号
872549
薬効分類名
経口避妊剤
承認等
マーベロン21
販売名コード
YJコード
254910CF1025
販売名英語表記
MARVELON 21 Tablets
販売名ひらがな
まーべろん
承認番号等
承認番号
21100AMY00154000
販売開始年月
2005年 4月
貯法・有効期間
貯法
室温保存
有効期間
3年
規制区分
処方箋医薬品
注1) 注意―医師の処方箋により使用すること
マーベロン28
販売名コード
YJコード
254910CF2021
販売名英語表記
MARVELON 28 Tablets
販売名ひらがな
まーべろん
承認番号等
承認番号
21100AMY00155000
販売開始年月
2006年 12月
貯法・有効期間
貯法
室温保存
有効期間
3年
規制区分
処方箋医薬品
注2) 注意―医師の処方箋により使用すること
主要文献
1) 水野正彦ほか. 日本不妊学会誌. 1991; 36: 35-48.
2) Viinikka L, et al. Acta Endocrinol. 1980; 93: 375-9.
3) 水野正彦ほか. 産科と婦人科. 1990; 57: 2507-32.
4) 高木繁夫ほか. 基礎と臨床. 1991; 25: 2807-16.
5) 水野正彦ほか. 産科と婦人科. 1992; 59: 149-59.
6) Hatcher RA, et al. Contraceptive Technology. Twentieth Revised Edition. NewYork: Ardent Media; 2011
7) Cullberg G, et al. Acta Obst Gynecol Scand. 1982; Suppl. 111: 29-38.
8) Mall-Haefeli M, et al. Geburtshilfe Frauenheilkd. 1984; 44: 177-9.
9) Viinikka L, et al. Acta Endocrinol. 1976; 83: 429-38.
10) 安全性に関する参考資料 腫瘍に関する事項
• Collaborative Group on Hormonal Factors in Breast Cancer:Lancet, 347:1713-1727, 1996
• WHO:Int J. Cancer, 55:228-236, 1993
• Ursin, G. et al.:Lancet, 344:1390-1394, 1994
• Ye, Z. et al.:Int J. Epidemiol., 24:19-26, 1995
• Thomas, D. B. et al.:Am. J. Epidemiol., 144:281-289, 1996
• 小川 重男ら:必修産婦人科学 改訂第4版, p.390, p.395-396, 南江堂, 1996
• Edmondson, H. A. et al.:N. Engl. J. Med., 294:470-472, 1976
• Neuberger, J. et al.:Br. Med. J., 292:1355-1357, 1986
• プリンシプル産科婦人科学婦人科編, p.618-623, メジカルビュー社, 1987
• 乳癌検診(日本対ガン協会編, 社会保険出版社, 1984)
• 乳癌集団検診の手引き(乳癌研究会編, 篠原出版, 1987)
• 乳癌の診断と治療(医薬ジャーナル, 1995)
• Becker, T. M. et al.:Int. J. Epidemiol., 23:913-922, 1994
• Parazzini, F. et al.:Br. J. Cancer, 77:838-841, 1998
• Zondervan, K. T. et al.:Br. J. Cancer, 73:1291-1297, 1996
• 永井 宣隆:臨婦産, 51:429-436, 1997
• Chie, W-C. et al.:Int. J. Cancer, 77:219-223, 1998
• Rooks, J. B. et al.:JAMA, 242:644-648, 1979
• Corfman, P. A.:Contraception, 37:433-455, 1988
• Mays, E. T. et al.:Semin. Liver Dis., 4:147-157, 1984
• Forman, D. et al.:Br. Med. J., 292:1357-1361, 1986
• WHO:Int. J. Cancer, 43:254-259, 1989
• The Collaborative MILTS(Multi-centre International Liver Tumor Study):Contraception, 56:275-284, 1997
11) 安全性に関する参考資料 心血管系に関する事項
• WHO:Lancet, 346:1575-1582, 1995
• Spitzer, W. O. et al.:Br. Med. J., 312:83-88, 1996
• WHO:Lancet, 348:498-505, 1996
• WHO:Lancet, 348:505-510, 1996
• Petitti, D. B. et al.:N. Engl. J. Med., 335:8-15, 1996
• WHO:Lancet, 349:1202-1209, 1997
• Lewis, M. A. et al.:Contraception, 56:129-140, 1997
• WHO Special Program of Research:Br. J. Obstet. Gynaecol., 98:1117-1128, 1991
• Jespersen, J. et al.:Am. J. Obstet. Gynecol., 163:396-403, 1990
• Layde, P. M. et al.:Lancet, I:541-546, 1981
• Stadel, B. V.:N. Engl. J. Med., 305:672-677, 1981
• 風間 睦美:Biomedical Perspectives, 6:85-89, 1997
• Bloemenkamp, K. W. M. et al.:Lancet, 346:1593-1596, 1995
• 丸山 征郎:血栓と循環, 4:21-23, 1996
• 野島 順三ら:臨床病理, 46:1181-1187, 1998
• Robinson, G. E. et al.:Br. Med. J., 302:269-271, 1991
• Vessey, M. P. et al.:Br. Med. J., 3:123-126, 1970
• 篠木 信敏ら:medicina, 33:1308-1310, 1996
• Gibbs, N. M.:Br. J. Surg., 45:209-236, 1957
• Kawasaki, T. et al.:Thrombosis Res., 79:147-151, 1995
• 高木 繁夫ら:綜合臨床, 34:1115-1119, 1985
• Jain, A. K. et al.:Studies in Family Planning, 8:50-54, 1977
• 「デソゲストレル又はゲストデン含有の経口避妊薬に関する欧州医薬品委員会(CPMP)声明(Position Statement)」, CPMP/374/96, 1996年4月17日
• 櫻川 信男ら:臨床血栓止血学, p.231, 医歯薬出版, 1994
• 脇坂 行一ら:病態血液学, p.477, 南江堂, 1978
• Farley, T. M. M. et al.:Contraception, 57:211-230, 1998
• Heinemann, L. A. J. et al.:Br. Med. J., 315:1502-1504, 1997
12) 安全性に関する参考資料 次世代への影響に関する事項
• 安田 佳子ら:医学のあゆみ, 98:537-538, 1976
• 安田 佳子ら:医学のあゆみ, 99:611-612, 1976
• Takasugi, N. et al.:J. Natl. Cancer Inst., 33:855-865, 1964
• 守 隆夫:医学のあゆみ, 95:599-602, 1975
• Huggins, G. R. et al.:Fertil. Steril., 54:559-573, 1990
• Corfman, P. A.:Contraception, 37:433-455, 1988
• Heinonen, O. P. et al.:N. Engl. J. Med., 296:67-70, 1977
• Harlap, S. et al.:Obstet. Gynecol., 55:447-452, 1980
• Savolainen, E. et al.:Am. J. Obstet. Gynecol., 140:521-524, 1981
• Ferencz, C. et al.:Teratology, 21:225-239, 1980
• Rothman, K. J. et al.:Am. J. Epidemiol., 109:433-439, 1979
• 常見 邦順ら:基礎と臨床, 24:4737-4756, 1990
• 原田 滋雄ら:薬理と治療, 19:S965-S999, 1991
• Kwarta, Jr. R. F. et al.:応用薬理, 42:327-340, 1991
• 影山 明彦ら:日獨医報, 36:284-299, 1991
• 先天異常調査20年のあゆみ:日本母性保護医協会, 1993
• 東京都立病産院における先天異常出産モニタリング調査
• Li, D. K. et al.:Teratology, 51:30-36, 1995
• Kim, M. R. et al.:Am. J. Obstet. Gynecol., 172:1042-1043, 1995
• 石塚 直隆:日本内分泌学会雑誌, 38:443-449, 1962
• Carr, D. H. et al.:Can. Med. Assoc. J., 103:343-348, 1970
• Lauritsen, J. G.:Acta Obstet. Gynecol. Scand., 54:261-264, 1975
• Dhadial, R. K. et al.:Lancet, Ⅱ:20-21, 1970
• Boue, J. et al.:Teratology, 12:11-26, 1975
• 松永 英:産婦人科治療, 32:88-93, 1976
• Harlap, S. et al.:Teratology, 31:381-387, 1985
• Depue, R. H. et al.:J. Natl. Cancer Inst., 71:1151-1155, 1983
• Henderson, B. E. et al.:Int. J. Cancer, 23:598-602, 1979
• Brown, L. M. et al.:Cancer Res., 46:4812-4816, 1986
• Moss, A. R. et al.:Am. J. Epidemiol., 124:39-52, 1986
13) 安全性に関する参考資料 妊娠機能に関する事項
• Woutersz, T. B.:J. Reprod. Med., 26:615-620, 1981
• Royal College of General Practitioners Oral Contraceptives and Health, p.71-77, Pitman Medical, London, 1974
• Mosher, W. D. et al.:Fertil. Steril., 56:192-193, 1991
• Chasan-Taber, L. et al.:Am. J. Epidemiol., 146:258-265, 1997
14) 安全性に関する参考資料 その他
• 厚生省医薬品副作用情報, No.28, 33-35, 1977
• Fisch, I. R. et al.:JAMA, 237:2499-2503, 1977
• Schwartman J. A. et al.:Rev. Bras. Oto-Rino-Laringol., 41:46-50, 1975
• Drill, V. A.:Am. J. Obstet. Gynecol., 119:165-174, 1974
• Orellana-Alcalde, J. M. et al.:Lancet, Ⅱ:1278-1280, 1966
• Koide, S. S. et al.:J. Reprod. Med., 15:214-224, 1975
• Nilsson, S.:Contraception, 17:131-139, 1978
• 吉本 雅昭ら:ホルモンと臨床, 44:597-605, 1996
• Chasan-Taber, L. et al.:Circulation, 94:483-489, 1996
• Godsland, I. F. et al.:J. Clin. Endocrinol. Metab., 74:64-70, 1992
• 二宮 涼子ら:臨床皮膚科, 48:281-283, 1994
• 降旗 謙一ら:最新医学, 35:2522-2527, 1980
• Harrison’s Principles of Internal Medicine, Eighth Edition, p.176, p.1450, 1977
• 岡田 弘二:ステロイド療法のあり方 産婦人科領域, p.171, 金芳堂, 1982
• Zimmerman, A. W.:Neurol. Clin. 4:853-861, 1986
• Burckhardt, P.:Hormone Res., 6:321-328, 1975
• Crook, D. et al.:Am. J. Obstet. Gynecol., 158:1612-1620, 1988
• Frey, B. M. et al.:Eur. J. Clin. Pharmacol., 26:505-511, 1984
• Abernethy, D. R. et al.:Clin. Pharmacol. Ther., 35:792-797, 1984
• セレギリン塩酸塩添付文書
• シクロスポリン添付文書
• Reimers, D. et al.:Prax. Pneumol., 25:255-262, 1971
• Back, D. J. et al.:Contraception, 21:135-143, 1980
• Back, D. J. et al.:Br. J. Pharmacol., 69:441-452, 1980
• Back, D. J. et al.:Br. J. Clin. Pharmacol., 25:527-532, 1988
• Crawford, P. et al.:Br. J. Clin. Pharmacol., 30:892-896, 1990
• Back, D. J. et al.:J. Steroid. Biochem., 16:407-413, 1982
• テルビナフィン塩酸塩添付文書
• ブセレリン酢酸塩添付文書
• Steel, J. M.:J. Fam. Plan. Doctors, 3:77-78, 1978
• ネルフィナビルメシル酸塩添付文書
• Ouellet, D. et al.:Br. J. Clin. Pharmacol., 46:111-116, 1998
• ネビラピン添付文書
• 檜垣 祐子:今日の治療指針, p713, 医学書院, 1999
• Van Vange, N. et al.:Contraception, 41:345-352, 1990
• 野口 實:日産婦誌, 40:14-20, 1988
• Schatz, D. L. et al.:Can. Med. Assoc. J., 99, 882-886, 1968
• 今釜 秀一ら:臨床眼科, 41:751-753, 1987
• Beral, V. et al.:Br. Med. J., 318:96-100, 1999
• Mostad, S. B. et al.:Lancet, 350:922-927, 1997
• Royal College of General Practitioners:Oral Contraceptives and Health, p.31, Pitman Medical, London, 1974
• Bray, R. S.:Contraception, 13:417-425, 1976
• Keller, A. J. et al.:Obstet. Gynecol., 49:83-91, 1977
• Gerretsen, G. et al.:Contraception, 22:25-29, 1980
• Baker, D. A. et al.:Contraception, 32:377-382, 1985
• Bisset, L. R. et al.:Contraception, 38:573-578, 1988
• Baker, D. A. et al.:Contraception, 39:119-124, 1989
• Scanlan, J. M. et al.:Psychoneuroendocrinology, 20:281-287, 1995
15) 有効性に関する参考資料 避妊効果に関する事項
• Hatcher, R. A. et al.:Contraceptive Technology:Twentieth Revised Edition. New York:Ardent Media,:p. 779-861, 2011
• Morris, S. E. et al.:Contraception, 20:61-69, 1979
• Chowdhury, V. et al.:Contraception, 22:241-247, 1980
• Sparrow, M. J.:N. Z. Med. J., 100:102-105, 1987
16) 有効性に関する参考資料 人工妊娠中絶に関する資料
• 平成9年母体保護統計報告(厚生省大臣官房統計情報部人口動態統計課)
• 毎日新聞人口問題調査会(第23回全国家族計画世論調査報告書より改編)
• Determinants of contraceptive use
• United Nations:Demographic Yearbook 1996版. ©1998
17) 有効性に関する参考資料 副効用に関する資料
• The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development:N. Engl. J. Med., 316:650-655, 1987
• Narod, S. A. et al.:N. Engl. J. Med., 339:424-428, 1998
• The Centers for Disease Control Cancer and Steroid Hormone Study:JAMA, 249:1596-1599, 1983
• The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development:JAMA, 257:796-800, 1987
• Schlesselman, J. J.:Hum. Reprod., 12:1851-1863, 1997
• Royal College of General Practitioners:Oral Contraceptives and Health, p.22, p.61, Pitman Medical, London, 1974
• Connel, E. B. et al.:J. Reprod. Med., 29:513-523, 1984
• Lanes, S. F. et al.:Am. J. Obstet. Gynecol., 166:956-961, 1992
• Vessey, M. et al.:J. Biosoc. Sci., 8:373-427, 1976
• Westrom, L.:Am. J. Obstet. Gynecol., 138:880-892, 1980
• Rubin, G. L. et al.:Am. J. Obstet. Gynecol., 144:630-635, 1982
• Brinton, L. A. et al.:Am. J. Epidemiol., 113:203-214, 1981
文献請求先及び問い合わせ先
オルガノン株式会社 カスタマーサポートセンター
東京都港区南青山1-24-3
フリーダイヤル 0120-095-213
保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
製造販売業者等
製造販売元
オルガノン株式会社
東京都港区南青山1-24-3





