一般的名称
レボノルゲストレル
禁忌(次の患者には投与しないこと)
-
- 本剤の成分に対し過敏症の既往歴のある女性
- 重篤な肝障害のある患者
- 妊婦
効能又は効果
緊急避妊
効能又は効果に関連する注意
- 本剤投与により完全に妊娠を阻止することはできない。
- 本剤は、避妊措置に失敗した又は避妊措置を講じなかった性交後に緊急的に用いるものであり、通常の経口避妊薬のように計画的に妊娠を回避するものではない。
組成・性状
組成
ノルレボ錠1.5
| 有効成分 | 1錠中 レボノルゲストレル 1.5mg |
| 添加剤 | 乳糖水和物、トウモロコシデンプン、ポビドン、軽質無水ケイ酸、ステアリン酸マグネシウム |
製剤の性状
ノルレボ錠1.5mg
| 剤形 | 白色素錠 | |
| 外形 | 表面 |  |
| 裏面 |  |
|
| 側面 | |
|
| 大きさ | 直径 | 約7mm |
| 厚さ | 約3.6mm | |
| 質量 | 140mg | |
| 識別コード | NL1.5 | |
用法及び用量
性交後72時間以内にレボノルゲストレルとして1.5mgを1回経口投与する。
用法及び用量に関連する注意
本剤を投与する際には、できる限り速やかに服用するよう指導すること。
用法及び用量
性交後72時間以内にレボノルゲストレルとして1.5mgを1回経口投与する。
用法及び用量に関連する注意
本剤を投与する際には、できる限り速やかに服用するよう指導すること。
重要な基本的注意
- 本剤の投与に際しては、問診等により、肝機能異常、心疾患、腎疾患及びその既往歴の有無を確認すること。
- 本剤投与後には、不正性器出血や妊娠初期の出血を月経と区別できない場合もあることから、月経周期を考慮し適切な時期に再来院するなど指導を行うこと。
相互作用
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
抗けいれん薬
HIVプロテアーゼ阻害剤
非ヌクレオシド系逆転写酵素阻害剤
リファブチン リファンピシン |
本剤の効果が減弱するおそれがある。 | これらの薬剤は肝の薬物代謝酵素を誘導し、本剤の代謝を促進すると考えられる。 |
| セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 | 本剤の効果が減弱するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | この食品は肝の薬物代謝酵素を誘導し、本剤の代謝を促進すると考えられる。 |
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
- 心疾患又はその既往歴のある患者
- ナトリウム又は体液の貯留により症状が増悪することがある
重度の消化管障害又は消化管の吸収不良症候群のある患者
本剤の有効性が期待できないおそれがある。
腎機能障害患者
- 腎疾患又はその既往歴のある患者
- ナトリウム又は体液の貯留により症状が増悪することがある。
肝機能障害患者
- 重篤な肝障害のある患者
- 投与しないこと。代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。
肝障害のある患者(重篤な肝障害のある患者を除く)
代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。
生殖能を有する者
- 本剤は性交後に妊娠を回避するためのものであり、計画的に避妊する場合は、可能な限り避妊効果の高い経口避妊薬などを用いて避妊すること。
- 本剤投与後も妊娠する可能性があるため、適切な避妊手段を指導すること。
- 本剤の投与に際しては、内診、免疫学的妊娠診断等により妊娠していないことを十分に確認すること。
妊婦
投与しないこと。妊娠初期・中期に投与した場合には、女性胎児の外性器の男性化又は男性胎児の女性化が起こることがある。
乳婦
授乳しないことが望ましい。本剤の成分は乳汁中に移行するので、本剤の投与後24時間は授乳を避けるよう指導すること。
相互作用
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
抗けいれん薬
HIVプロテアーゼ阻害剤
非ヌクレオシド系逆転写酵素阻害剤
リファブチン リファンピシン |
本剤の効果が減弱するおそれがある。 | これらの薬剤は肝の薬物代謝酵素を誘導し、本剤の代謝を促進すると考えられる。 |
| セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 | 本剤の効果が減弱するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | この食品は肝の薬物代謝酵素を誘導し、本剤の代謝を促進すると考えられる。 |
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
その他の副作用
| 5%以上 | 0.1~5%未満 | 頻度不明 | |
| 精神神経系 | 頭痛(12.3%)、傾眠 | 浮動性めまい、体位性めまい、不安 | |
| 生殖器 | 消退出血(46.2%)、不正子宮出血(13.8%) | 月経過多 | 月経遅延 |
| 消化器 | 悪心 | 下腹部痛、下痢、腹痛 | 嘔吐 |
| 血液 | 貧血 | ||
| その他 | 倦怠感 | 異常感、口渇、熱感、疲労、末梢性浮腫 | 乳房圧痛 |
適用上の注意
薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
薬物動態
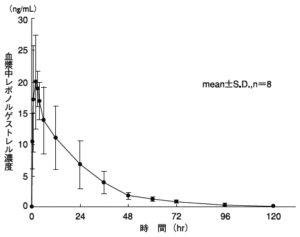
血中濃度
日本人健康成人女性8例に0.75mg製剤2錠(レボノルゲストレルとして1.5mg)を単回経口投与した場合の薬物動態パラメータ及び血漿中濃度を下表及び下図に示す 。
| Cmax(ng/mL) | Tmax(hr) | AUC0-120(ng・hr/mL) | T1/2(hr) |
| 23.87±8.01 | 2.88±2.03 | 435.66±115.44 | 24.72±3.49 |
| (mean±S.D., n=8) | |||
分布
蛋白結合率
- 血漿蛋白結合率は93~95%で、蛋白結合分布はアルブミン50%、SHBG(性ホルモン結合グロブリン)及びCBG(コルチゾール結合グロブリン)48%であった。
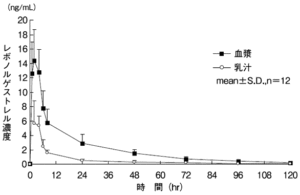
乳汁への移行
分娩後6~12週の被験者12例にレボノルゲストレル1.5mgを投与し、投与前、1、2、4、6、8、24、48、72、96及び120時間後の血漿中並びに母乳中のレボノルゲストレル濃度を測定した結果、レボノルゲストレルは、投与2時間後までに速やかに乳汁中に移行し、2時間から4時間の間にピークに達した。その後、乳汁中レボノルゲストレル濃度は、投与8時間後でピークの27%、投与24時間後でピークの9%まで減少した。乳汁中レボノルゲストレル濃度推移と血漿中レボノルゲストレル濃度推移はパラレルな経時的変化を示し、乳汁中レボノルゲストレル濃度のAUC0-tと血漿中レボノルゲストレル濃度のAUC0-tの比は0.28:1であった
代謝
肝でグルクロン酸抱合体、硫酸抱合体に代謝される 。
16.5 排泄
14Cで標識したd-ノルゲストレル(レボノルゲストレル)1.5mgを単回経口投与後、7日目までの尿中排泄は44.8±8.9%、糞中排泄は31.6±8.2%であり、尿中・糞中を合算して総投与放射能の約80%が回収された (外国人データ)。
臨床成績
17.1 有効性及び安全性に関する試験
- 17.1.1 国内第III相試験
- 性交後72時間以内に0.75mg製剤2錠(レボノルゲストレルとして1.5mg)を1回経口投与した結果、解析対象例63例のうち、妊娠例は1例で、妊娠阻止率は81.0%であった。
副作用発現頻度は72.3%(47例/65例)で、主な副作用は、消退出血46.2%(30/65例)、不正子宮出血13.8%(9/65例)、頭痛12.3%(8/65例)、悪心9.2%(6/65例)、倦怠感7.7%(5/65例)、傾眠6.2%(4/65例)等であった 。
注) 妊娠阻止率:月経周期日ごとの妊娠確率から求めた妊娠予定数を用いて算出した値
海外第III相試験
性交後72時間以内に他のレボノルゲストレル製剤1.5mgを1回経口投与した際の妊娠率及び妊娠阻止率は以下のように報告されている。
| 投与日 | 妊娠率 (妊娠例数/評価症例数) |
妊娠阻止率 |
| 性交後1~3日 (0~72時間) |
1.34% (16/1198) |
84% |
主な副作用は、不正子宮出血31.3%(426/1359例)、悪心13.9%(189/1359例)、疲労13.5%(184/1359例)、下腹部痛13.5%(183/1359例)、頭痛10.4%(142/1359例)、浮動性めまい9.7%(132/1359例)、乳房圧痛8.3%(113/1359例)、月経遅延4.6%(62/1359例)であった
薬効薬理
作用機序
本剤の子宮内膜に及ぼす作用、脱落膜腫形成に及ぼす作用、受精卵着床に及ぼす作用、子宮頸機能に及ぼす作用及び排卵・受精に及ぼす作用に関する各種非臨床試験を行った結果、本剤は主として排卵抑制作用により避妊効果を示すことが示唆され、その他に受精阻害作用及び受精卵着床阻害作用も関与する可能性が考えられた。
排卵抑制作用
成熟雌性ウサギを精管切断した雄性ウサギと不妊交尾させ、不妊交尾後27日目にレボノルゲストレル(LNG)を単回経口投与した。同28日目に繁殖力のある雄と交尾させ、24時間後に屠殺して卵巣内の破裂卵胞数及び卵管中の卵数を計測した結果、LNG1,000μg/匹が投与された全て(4匹)に排卵抑制が観察された
子宮内膜に関する作用
- 未成熟雌性チンチラウサギに安息香酸エストラジオール2μg/匹を8日間反復皮下投与した後、LNGを6日間にわたり計10回反復経口投与した。子宮腺の発達の程度をスコア化(McPhailスコア)した結果、LNGの反復経口投与(総投与量60μg/匹以上)により、子宮腺の発達が認められた。
- 未成熟雌性チンチラウサギに安息香酸エストラジオール5μg/匹を3回皮下投与した後、LNGを子宮内に単回投与した。72時間後に子宮内膜の変化をスコア化(McPhailに準じた子宮内膜所見スコア)した結果、LNGは20μg/匹で4匹中2匹に子宮内膜の分泌期変化を誘発した 。
脱落膜腫形成作用
雌性マウスの卵巣を摘出し(1日目)、6日目に子宮をナイロン糸で傷害した。LNGを5日目から8日目まで4日間反復経口投与し、9日目に子宮重量の測定及び組織学的に脱落膜腫様変化を評価した結果、250μg/匹/日以上の投与で脱落膜腫形成作用を示した。
子宮頸機能に関する作用
成熟雌性ウサギを精管切断した雄性ウサギと不妊交尾させた。不妊交尾後26日目に雄性ウサギから回収した精液を腟内に注入するとともに、排卵を促すためヒト絨毛性ゴナドトロピンを静脈内投与した。LNGを不妊交尾後20日目から27日目まで連続経口投与し、28日目にウサギを屠殺して卵巣内の破裂卵胞数、生殖管内の卵数及び受精卵数を計測した結果、1,000μg/匹/日で受精率が低下した 。
避妊作用
性皮の最大腫脹期にある雌性ヒヒを雄性ヒヒのケージに6時間入れた後、6時間以内にLNGを単回経口投与した。その後性皮の変化あるいは月経を観察した結果、交尾直後の雌性ヒヒにLNGの400μg/匹を単回経口投与することにより、避妊作用が認められたが、性周期の乱れは観察されなかった 。
有効成分に関する理化学的知見
一般的名称
レボノルゲストレル(Levonorgestrel)
化学名
18α-Homo-19-nor-17β-hydroxy-17α-pregn-4-en-20-yn-3-one
分子式
C21H28O2
分子量
312.45
性状
白色の結晶性の粉末である。
ジクロロメタンにやや溶けにくく、エタノールに溶けにくく、水にほとんど溶けない。
化学構造式
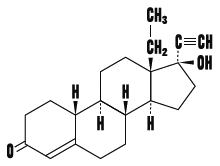
融点
232~239℃(ただし、融点の範囲は4℃以内)
取扱い上の注意
- 外箱に入れ直射日光を避けて保管すること。
- 外箱開封後は遮光して保存し、できる限り速やかに使用すること。
包装
1錠[1錠(PTP)×1]
主要文献
1) 社内資料:薬物動態試験、成人女性単回投与
2) Gainer,E.et al.:Human Reproduction.2007;22(6):1578-1584
3) Martindale.The Extra Pharmacopoeia 36th Ed.2009:p.2121-2122
4) Sisenwine,S.F.et al.:Drug Metab.Dispos.1975;3(3):180-188
5) 社内資料:国内第III相臨床試験成績
6) Wilcox,A.J.et al.:New Engl.J.Med.1995;333(23):1517-1521
7) Hertzen,H.et al.:Lancet.2002;360(9348):1803-1810
8) Van der Vies,J.et al.:Arzneimittelforschung.1983;33(2):231-236
9) Oettel,M.et al.:Contraception.1980;21(5):537-549
文献請求先及び問い合わせ先
あすか製薬株式会社 くすり相談室
〒108-8532 東京都港区芝浦二丁目5番1号
TEL 0120-848-339
FAX 03-5484-8358
保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
製造販売業者等
製造販売元
あすか製薬株式会社
東京都港区芝浦二丁目5番1号
販売元
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号
提携
LABORATOIRE HRA PHARMA






